A Palmer és Bhakdi által összeállított eredmények kiegészítik a Sciencefiles által korábban bemutatott öt útvonalat, amelyeken keresztül az mRNS-génterápiák képesek kárt okozni az emberi szervezetben. Ha még nem ismerjük ezt az öt utat és az őket alátámasztó szakirodalmat:
|
A következőkben részletesen tárgyaljuk ezeket az útvonalakat, olyan tanulmányok alapján, amelyek ezt a károkozást a megfelelő bizonyítékokkal alátámasztják.
I. Az exoszómák terjesztik a tüskefehérjét a véráramban
| Sandhya Bansal; Sudhir Perincheri; Timothy Fleming; Christin Poulson; Brian Tiffany; Ross M. Bremner; Thalachalour Mohanakumar (2021). Cutting Edge: Circulating Exosomes with COVID Spike Protein Are Induced by BNT162b2 (PfizerBiontech) Vaccination prior to Development of Antibodies: A Novel Mechanism for Immune Activation by mRNA Vaccines [a BNT162b2 (PfizerBiontech) vakcinázás gerjeszti a COVID tüskefehérjével rendelkező keringő exoszómákat az antitestek kialakulása előtt: Az mRNS-vakcinák által történő immunaktiválás új mechanizmusa.] Journal of Immunology. |
Az mRNS-vakcinák / génterápiák lényege, hogy a lipid nanorészecskék a hozzájuk kapcsolódott tüskefehérje mRNS-t az emberi sejtekbe szállítják. A hivatalos magyarázat szerint ott a riboszómák felveszik az mRNS-t, melyek így tüskefehérjét alkotnak, ami egyrészt antitestek képződéséhez vezet, másrészt az endoszómák felveszik és felaprítják a tüskefehérjéket. . Ez mind szép és jó, de a történetnek itt még nincs vége, ahogyan arra Bansal és társai (2021) rámutattak. Az endoszómák ugyanis a tüskefehérjét úgyszólván exoszómákba csomagolják, és ezeket az exoszómákat kilökik a sejtből, egyenesen a véráramba.
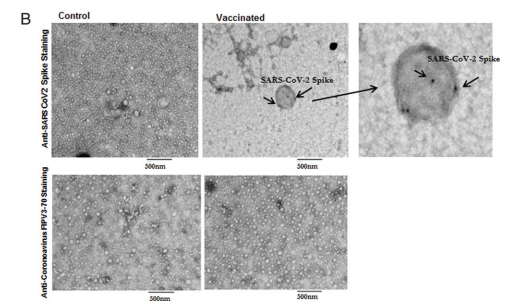
Forrás: Bansal et al. (2021)
A jobb felső ábra két, elektronmikroszkóppal készített képet mutat, amelyeken a tüskefehérjéket hordozó exoszómák láthatók. Az mRNS-tüskefehérjék története tehát nem ért véget a sejtekben, hanem a véráramban folytatódik.
Hogy miként néz ki ez a folytatás, azt a szerzők nyolc beoltott önkéntes, illetve egy kontrollcsoport vérvizsgálatával hasonlították össze. A kontrollcsoport összetétele a következő volt:
10 egészséges, tesztpozitív felnőtt
20 kétszer oltott személy
20 oltatlan, negatív teszteredmény felmutató személy.
A vérmintákat a nyolc fős csoportból
a Pfizer-oltás (BNT162b2/Comirnaty-kezelés) előtt
a kezelés napján
hét és
14 nappal az első kezelés után,
14 nappal a második kezelés után és négy hónappal a második kezelés után vették.
Az itt közölt eredmények tehát statisztikailag szignifikáns eltéréseket mutatnak a vizsgált személyeknél a BNT162b2/Comirnaty vakcinázást követően.
A kutatók 14 nappal az első BNT162b2/Comirnaty-kezelés (“oltás”) után “beoltottak” vérében tüskefehérjét (vagy S2-t) hordozó exoszómákat találtak.
Csak 14 nappal a második BNT162b2/Comirnaty-kezelés után találnak antitesteket a tüskefehérje ellen.
A tüskefehérjét hordozó exoszómák mennyisége a második kezelést követő 14 nap elteltével jelentősen megnövekedett az első kezelést követő 14 naphoz képest.
A kutatók még négy hónappal a BNT162b2/Comirnaty-val végzett második kezelés után is találtak a “beoltottak” vérében a tüskefehérjét hordozó exoszómákat.
Ennyit arról, hogy az mRNS a helyén marad (1), az emberi sejtekben a tüskefehérjék kialakulása után azonnal megsemmisül (2), és azonnal antitestek kialakulásához vezet (3). Inkább úgy tűnik, hogy a tüskefehérjét hordozó exoszómák, bárhová is kerüljenek az emberi szövetekbe, immunreakciót váltanak ki, amely gyulladással jár. Hogy ez így van, azt a szerzők a tüskefehérjét hordozó exoszómákkal injektált egereken végrehajtott, szinte rituálisnak tekinthető gyilkossággal bizonyították be. Harminc nappal az injekció beadása után az egerek lépét és vérét levették, és megállapították, hogy a gyulladásra utaló markerek szintje jelentősen megnövekedett, különösen az INFγ (interferon-citokin) és a TNFα (tumor nekrózis faktor) markereké, mindkettő a szervezet immunválaszának eredménye, ami viszont gyulladásra utal.
II. Az S1 fehérje és a tüskefehérje lebeg a vérben
| Ogata, Alana F., Chi-An Cheng, Michaël Desjardins, Yasmeen Senussi, Amy C. Sherman, Megan Powell, Lewis Novack és mások (2022). Circulating severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) vaccine antigen detected in the plasma of mRNA-1273 vaccine recipients. [A súlyos akut légzőszervi szindrómás koronavírus (SARS-CoV-2) vakcina antigénjének keringése az mRNS-1273 vakcinával oltottak plazmájában.] Clinical infectious diseases 74(4): 715-718. |
Ogata és munkatársai (2022) S1 fehérjét és tüskefehérjét találtak a kétszeresen vakcinázott egyének vérplazmájában. Eredményeik 13 egészségügyi dolgozó vérmintáin alapulnak, akiktől 10-13 időpontban vettek vért az első és a második oltás után. Az oltás a Moderna mRNA-1273 génterápiával történt. Várható, hogy a BNT162b2, a Pfizer/Biontech génterápiája esetében az eredmények hasonlók lesznek.
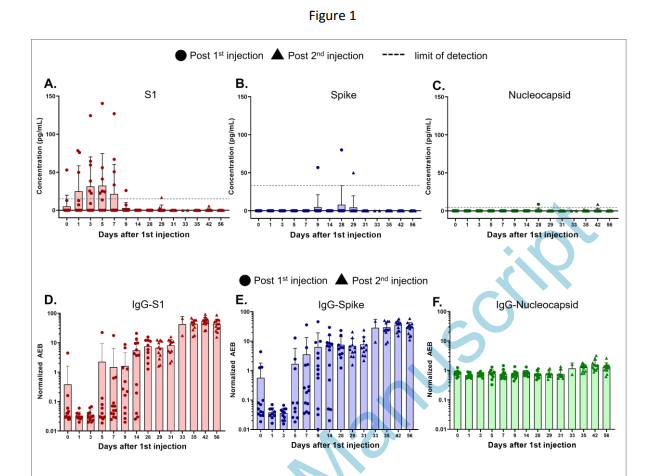 Ogata et al (2021). Közzétételre elfogadott kézirat.
Ogata et al (2021). Közzétételre elfogadott kézirat.
Az ábra felső felében látható: Az S1 fehérje az első oltást követő hét napig megtalálható a beoltott egyének vérében. Az összes tüskés fehérje megtalálható néhány beoltott egyén vérében az első oltást követő tíz napig.
A Moderna (és a Pfizer/Biontech) által terjesztett oltási narratíva szerint ennek nem szabadna így lennie. Ez a narratíva még mindig azt állítja, hogy a beadott mRNS helyhez kötött marad. A gyakorlat viszont határozottan ellent mond ennek. Nem elég, hogy az S1 fehérje (a tüskefehérje két összetevőjének egyike, amely hordozza az RBD-t) az mRNS beadása után azonnal megtalálható a vakcinázottak vérében, a vakcinázottak egy részénél a Moderna mRNS-1273-mal történő kezelés után 8-10 nappal is megtalálható a tüskefehérje. A szerzők ezt a tényt azzal magyarázzák, hogy a CD8+ T-sejtek, azaz a killer T-sejtek a tüskefehérje mRNS-ből történő képzése után elpusztítják azokat a sejteket, amelyek felszínén az antigén megjelenik, ami azt eredményezi, hogy ezekből a sejtekből a tüskefehérje a véráramba kerül. Evvel a COVID-19 mRNS-génterápiák készítői nem számoltak. A vérben szabadon lebegő tüskés fehérjék következtében a szövetekben vagy szervekben szinte válogatás nélkül gyulladás léphet fel (lásd alább).
III. Antitest-függő felerősödés (Antibody Dependent Enhancement, ADE) – a tüskefehérje antitesteket használ a monociták[1] behálózásához
Eddig az volt a narratíva, hogy a SARS-CoV-2 az ACE-2 receptorokon keresztül jut be az emberi sejtekbe. Ez így nem teljes, ahogy ebből a tanulmányból is kiderül:
| Junqueira, Caroline, Ângela Crespo, Shahin Ranjbar, Luna B. de Lacerda, Mercedes Lewandrowski, Jacob Ingber, Blair Parry és mások (2022). FcγR-mediated SARS-CoV-2 infection of monocytes activates inflammation.A monociták FcγR által közvetített SARS-CoV-2 fertőzése gyulladást aktivál. Nature (2022): 1-13 |
Ebben a tanulmányban a szerzők azt mutatják, hogy a SARS-CoV-2 az FCγR-en keresztül a monocitákhoz (a leukociták egy altípusához) csatlakozó antitesteket használja ki ezeknek a monocitáknak a behálózásához. A monociták viszont a SARS-CoV-2 fertőzést alkalomnak tekintik arra, hogy öngyilkosságot kövessenek el, de nem anélkül, hogy előbb ne képeznének inflammaszómákat[2], amelyek az immunrendszer számára az ellenséges invázió visszaverésére irányuló általános mozgósításra hívják fel a figyelmet. Sok esetben a védekezés citokinviharral zajlik. A vége tüdőgyulladás és gyakran az azt követő halál.
Értelemszerűen;
azok halálesetei – akik a COVID-19-ben haltak meg a “világjárvány” során, és akikkel saját immunrendszerük végzett citokinvihar útján – az antitest-függő felerősödés (Antibody Dependent Enhancement, ADE) ezen formájának tulajdoníthatók. Mindenesetre Junqueira et al (2022) munkája bizonyítékot szolgáltat arra, amitől sokan tartottak: A SARS-CoV-2 nem csak a tüskefehérjén és az emberi sejtek ACE2-receptorain keresztül képes beszivárogni az emberi sejtekbe, hanem az ADE-n keresztül is. A monociták nem rendelkeznek ACE2-receptorokkal, így a hozzáférésnek ADE-n és FCγR-en keresztül kell történnie.
Most már mindenki egy kezén meg tudja számolni, hogy az a tény, hogy a SARS-CoV-2 képes olyasmire, amitől eddig egyesek tartottak, de a legtöbb kutató, aki ezzel foglalkozott, valószínűtlennek tartotta, mit jelent a COVID-19 vakcinák / génterápiák számára, amelyek a tüskefehérje gyártási utasításait juttatják az emberi sejtekbe, amit ebben a tanulmányban ADE-képes inváziós anyagként írtak le.
Az oltási fanatikusok nem csak hogy minden járványkezelési alapszabályt felrúgva beleoltottak egy zajló világjárványba, biztosítva, hogy bőségesen el legyünk látva SARS-CoV-2 variánsokkal, hanem olyan löttyökkel kísérleteztek, amelyeknek jelentős egészségügyi következményeit nem tudták és nem is tudják előre látni, ezért ezeket letagadják. Ehhez jön még, hogy SARS-CoV-2 génszekvenciákkal kísérletezgettek, úgy, hogy senki sem tudja, ezek milyen “képességeket” fejleszthetnek ki.
Vihar készülődik, nem csak egy citokin vihar.
IV. A tüskefehérje károsítja a DNS-javító rendszert
| Jiang, Hui és Ya-Fang Mei (2021). SARS–CoV–2 Spike Impairs DNA Damage Repair and Inhibits V (D) J Recombination In Vitro. A SARS-CoV-2 tüske rontja a DNS-károsodás javítását és gátolja a V (D) J rekombinációt, In Vitro. Viruses 13(10): 2056. |
A HR (homológ rekombináció) és az NHEJ (non-homologous end-joining) két olyan javítórendszer, amelyek fontosak a genom integritásának fenntartásában (kettős törések esetén), és amelyek (különösen az NHEJ) fontosak a b- és T-sejtek előállításában. Ha az első zavart szenved, ellenőrizetlen sejtnövekedés (azaz rák) vagy sejtpusztulás következik be; ha az utóbbi zavart szenved, immunhiány lép fel.
Az a vírus, amelynek sikerül átvennie vagy veszélyeztetnie a leírt javítórendszert, ellenőrzést nyer az immunrendszer felett, növeli saját túlélési valószínűségét vagy szaporodási képességét. Ezenkívül a DNS-javító rendszer károsodása a rák és az apoptózis (sejthalál) lehetőségéhez vezet, ha a zavar tartós. Röviden, az NHEJ javító funkciójának megzavarása tehát nemcsak a genom integritásának megzavarásával jár, hanem a V(D)J rekombinációs folyamat megzavarásával is, amely az immunrendszerben a b- és T-sejtek termeléséért felelős. Ahhoz, hogy egy vírus ilyen bomlást idézzen elő, be kell jutnia a sejtmagba.
Hui Jiang és Ya-Fang Mei megmutatják tanulmányukban, hogy a teljes tüskefehérje sikeresen behatol a sejtmagba. Meglepetésükre a kutatók több spike-fehérjét találtak a sejtmagban, mint a sejtmembránban. Ez annyiban sajnálatos, hogy az mRNS génterápiák, mint például a Pfizer/Biontech COMIRNATY-ja, a teljes tüskefehérjét hordozzák:
“A COMIRNATY (ebben a dokumentumban BNT162b2 néven is említett) a SARSCoV-2 vírus spike glikoproteinjét (S) kódoló, nukleoziddal módosított hírvivő RNS-t (mRNS) tartalmaz, amely lipidekben van megformázva, beleértve a ((4-hidroxibutil)azándiil)bisz(hexán-6, 1-diil)bisz(2-hexildecanoát), 2-(polietilénglikol 2000)-N,N-ditetradecil-acetamid, 1,2-disztearoil-sn-glicero-3-foszfokolint és koleszterint.”
A sejtmag a sejtek irányítóközpontja. Itt található a DNS, és innen indulnak ki azok az információk, amelyek a sejtnövekedéshez, a sejtosztódáshoz vagy a sejthalálhoz vezetnek. Ebből a szempontból zavaró, hogy a tüskefehérjét az emberi sejtek magjában találjuk.
“Meglepő módon bőséges mennyiségben találunk tüskefehérjét a sejtmagban. Az NHEJ-javítás és a homológ rekombinációs (HR) javítás két olyan fontos DNS-javítási útvonal, amelyek nemcsak a genom integritását felügyelik és biztosítják folyamatosan, hanem az adaptív immunsejtek működéséhez is elengedhetetlenek.”
Nos, az a tény, hogy a SARS-CoV-2 spike-fehérje be tud jutni a sejtmagba, nem ad okot aggodalomra mindaddig, amíg a spike-fehérje nem képes megzavarni a sejtmagból irányított javítórendszert, és itt elsősorban az NHEJ javítórendszert. Jiang és Mei azonban pontosan ezt állapította meg humán HEK293 [humán embrionális vesesejtek] sejtekkel végzett vizsgálataiban:
“Annak meghatározására, hogy a tüskefehérje hogyan gátolja úgy az NHEJ, mint a HR javítási útvonalakat, elemeztük a BRCA1 és az 53BP1 összegyűjtését, amelyek a HR és az NHEJ javítás kulcsfontosságú ellenőrzőpont fehérjéi. Azt találtuk, hogy a tüskefehérje jelentősen gátolta úgy a BRCA1, mint az 53BP1 fókuszok kialakulását (…). Ezek az adatok együttesen azt mutatják, hogy a SARS-CoV-2 teljes hosszúságú tüskefehérje gátolja a DNS-károsodás javítását azáltal, hogy akadályozza a DNS-javító fehérjék összegyűjtését.”
A szerzők tehát a SARS-CoV-2 teljes hosszúságú tüskefehérjét a sejtmagban találják, ahonnan a tüskefehérje nyilvánvalóan sikeresen beavatkozik a DNS-javító rendszerbe, és különösen a kórokozók elleni hatékony immunvédelemhez nélkülözhetetlen b- és T-sejtek termelődését zavarja, akadályozza.
“A DNS-károsodások javítása, különösen az NHEJ-javítás, elengedhetetlen a V(D)J-rekombinációhoz, amely a B- és T-sejtes immunitás középpontjában áll. Eddig számos engedélyezett SARS-CoV-2 vakcinát, például mRNS-vakcinákat és adenovírus-COVID-19 vakcinákat fejlesztettek ki a teljes hosszúságú tüskefehérje alapján.”
Ez a kutatás “in vitro”[3]. Nem bizonyított, hogy az mRNS-génterápiák, mint például a Pfizer/Biontech COMIRNATY-ja, megzavarják a DNS-javító funkciót, és immunhiányhoz és rákhoz vezetnek. Ennek csupán lehetőségét vázolta fel, mert az eredmények arra utalnak, hogy az mRNS- vagy adenovírus alapú vakcinákkal/ génterápiákkal végzett vakcinázás/ génterápia következményeként immunhiány és rákos megbetegedések alakulhatnak ki. Jian és Mei megállapításai szerint azonban ezek valószínűsíthetők.
V. Az mRNS vakcinák károsítják a szervezet immunválaszát
| Seneff, Stephanie, Greg Nigh, Anthony M. Kyriakopoulos és Peter A. McCullough (2022). Innate Immune Suppression by SARS-CoV-2 mRNA Vaccinations: The role of G-quadruplexes, exosomes and microRNAs. A SARS-CoV-2 mRNS-vakcinációval történő veleszületett immunszuppresszió: a G-kvadruplexek, az exoszómák és a mikroRNS-ek szerepe. Authorea Preprints (2022). |
Az interferonok (IFN-ek) fontos szerepe a kórokozókkal szembeni emberi immunválasz kiváltásában és szervezésében jól ismert. Központi szerepet játszanak a kórokozó, a vírus szaporodásának megakadályozásában, valamint a kórokozóval szemben hatékonyan harcoló és azt semlegesítő antitestek előállításában:
“Az IFN-ek tehát kritikus szerepet játszanak mind a vírusproliferáció[4] szabályozásában, mind az antitesttermelés indukálásában. Az IFN-α központi szerepet játszik úgy a vírusellenes, mint a rákellenes immunitásban. Az IFN-α-t a makrofágok és a limfociták termelik, amikor vírusos vagy bakteriális fertőzés éri őket, vagy amikor tumorsejtekkel találkoznak.”
Az I. típusú interferonok különösen fontosak a rák elleni küzdelemben, például a károsodott sejtek ártalmatlanítása révén.
“Az IFN-α expresszió által kiváltott rákellenes hatások köre megdöbbentő, és mind közvetlen, mind közvetett mechanizmusokon keresztül jelentkezik. A közvetlen hatások közé tartozik többek között a sejtciklus leállítása, a sejtdifferenciálódás indukciója, az apoptózis beindítása, a természetes ölősejtek és a CD8+ T-sejtek aktiválása.”
[…]
“Az IFN-α a rák elnyomó szerepeinek széles skáláját indítja el és irányítja.”
Az interferonok, ha úgy tetszik, problémát jelentenek az mRNS-vakcinák számára, amelyek fő problémája a túlélés egy velük szemben ellenséges szervezetben. Annak érdekében, hogy az emberi immunrendszer ne pusztítsa el az mRNS-vakcinákat röviddel az injekció beadása után, az mRNS-vakcináknak számos trükköt kell alkalmazniuk, például genetikailag módosítaniuk kell a SARS-CoV-2 genomjának néhány pozícióját, többek között azért, hogy az emberi immunrendszer azt higgye, hogy az mRNS-génterápia emberi RNS. Ahhoz, hogy az mRNS elég sokáig fennmaradjon az emberi szervezetben, stabilabbá és tartósabbá kell tenni az mRNS-t, amit az elmúlt 30 évben sikerült is elérni némi sikerrel:
“Az elmúlt évek során az IVT [in vitro átírt] mRNS-ek előállításának technikai fejlődése (5′ sapkamódosítások, optimalizált GC-tartalom, javított poliA-farkak, stabilizáló UTR-ek) olyan mértékben növelte az IVT mRNS-ek stabilitását, hogy az mRNS közvetlen in vivo beadása után még napokkal is elérhető a fehérje expressziója.“.
Hogy az idegen mRNS-t az emberi sejtekbe juttassák, az mRNS-vakcinák a humán RNS utánzásával megkerülik az emberi immunrendszert. A lipid nanorészecskék, amelyekbe az mRNS-t csomagolták, bejutnak a sejtekbe. Ott az mRNS-t a riboszómák felveszik, és a spike-fehérjébe viszik át, amely nem az “eredeti” spike-fehérje, hanem a spike-fehérje genetikailag módosított változata. Miután az ál-tüskefehérje elkészült, a kórokozónak három másik útja van:
- Néhányat lebontanak, és töredékeik a gyilkos T-sejtek elé kerülnek, hogy tovább pusztítsák őket;
- Néhányuk az emberi sejt felszínére vándorol, ahol a gyilkos T-sejtek ártalmatlanítják őket;
- Egyesek az exoszómák hátán hagyják el az emberi sejtet, és velük együtt utaznak az emberi szervezetben (lásd fentebb).
Röviden, az elképzelés lényege, hogy az mRNS-vakcinák a kívánt célt (azaz a módosított tüskefehérje előállítását) olyan lopakodó stratégiával érik el, amely megkerüli az RNS-típusú vírusfertőzésre adott természetes immunológiai választ. Az mRNS-t tartalmazó befecskendezett lipid nanorészecskék endocitózis útján jutnak a sejt belsejébe. Az mRNS megszabadul a lipidhordozójától, és a riboszómához vándorol, ahol egy optimalizált programot követve nagy mennyiségben, hosszú időn keresztül egy adott fehérje nagy mennyiségű előállítására állítják rá.
Ezek a módosított SARS-CoV-2 tüskés glikoproteinek ezután három elsődleges útvonal egyikét követik.
Néhányat proteolitikusan lebontanak, és a töredékek az MHC I. osztályú molekulákhoz kötődnek, hogy a felszínen a citotoxikus T-sejtek számára megutatkozhassanak.
Egy második útvonal során ugyanezek a tüskés glikoprotein fragmentumok kötődnek az MHC II. osztályú molekulákhoz, majd a sejtfelszínre jutnak, és aktiválják a T-helper sejteket.
Egy utolsó útvonalon az oldható spike-glikoproteinek exoszómákban extrudálódnak a sejtből, ahol a B-sejtek által aktivált spike-glikoprotein-specifikus antitestek felismerhetik őket [82].
A SARS-CoV-2 tüskefehérje módosítja az emberi szervezet immunválaszát, különösen képes megzavarni az IFR9 [interferon szabályozó faktor] termelését, amely fontos szerepet játszik a rák ellen küzdő sejtek aktiválásában. Ezenkívül a tüskefehérje hatására számos génátirat aktiválódik, amelyek készen állnak a gyulladás elleni küzdelemre. Ugyanígy működnek az mRNS-vakcinák / génterápiák is.
A leírt folyamatok által okozott károk:
1, Az immunválasz károsítása mRNS génterápiák által I. típusú interferon esetében:
Az mRNS-vakcinák / génterápiák (amelyeken 2019 előtt 30 évig dolgoztak (sikertelenül)) megváltoztatják az I. típusú interferonok jelátviteli viselkedését, ami a COVID-19 vakcinázást / génterápiát követő első két hétben a COVID-19 megbetegedés megnövekedett kockázatával jár. Ezt mutatja Janeway és Medzhitov tanulmánya.
| Janeway Jr, Charles A., & Ruslan Medzhitov (2002). Veleszületett immunfelismerés.” Annual review of immunology 20(1): 197-216. |
Hadjadj és munkatársai (2020) tanulmánya azt mutatja, hogy a COVID-19-ben súlyosan beteg betegeknél az IFN-I immunválasz súlyosan károsodott:
“Ezeknél a betegeknél lényegében nem volt IFN-β, illetve alacsony volt az IFN-α termelés és aktivitás. Ez tartós vérvírus-terheléssel és súlyosbodott gyulladásos válasszal járt együtt, amelyet az α tumor nekrózis faktor (TNF-α) és az Il-6 magas szintje jellemzett. A szerzők az I. típusú IFN terápiát javasolták lehetséges kezelési lehetőségként.”
| Hadjadj, Jérôme, Nader Yatim, Laura Barnabei, Aurélien Corneau, Jeremy Boussier, Nikaïa Smith, Hélène Péré et al. “Impaired type I interferon activity and inflammatory responses in severe COVID-19 patients.” (Csökkent I. típusú interferon aktivitás és gyulladásos válaszok súlyos COVID-19 betegeknél). Science 369(6504): 718-724. |
Kimutatható tehát az összefüggés az I. típusú interferon által szabályozott immunválasz elfojtása és a súlyos betegség között. Ez leírja az emberi szervezetekben a tüskefehérje vagy pszeudo-tüskefehérje által okozott károk útját, amelynek tervrajzát mRNS-vakcinák / génterápiák szállítják az emberi sejtekbe.
2, Szabad lebegés az exoszómákon (mRNS partizánháború):
A Mishra és Banerjea (2021) által végzett tanulmány azt mutatja, hogy a tüskefehérjét terjesztő exoszómákat a mikroglia sejtek, az agy immunsejtjei veszik fel, és ennek eredményeképpen gyulladásos immunválasz indul be.
“Feltételezzük, hogy a SARS-CoV-2 géntermék, a Spike képes módosítani a gazdaszervezet exoszomális szállítását, amely távoli, nem fertőzött szövetekbe és szervekbe kerül, és katasztrofális immun láncreakciót indíthat el a Központi Idegrendszerben (CNS).”
A mikroglia központi idegrendszeri gyulladásban játszott szerepe jól ismert többek között a HIV és a dengue-fibrillációval kapcsolatos vizsgálatokból.
| Mishra, Ritu és Akhil C. Banerjea (2021). SARS-CoV-2 spike targets USP33-IRF9 axis via exosomal miR-148a to activate human microglia. A SARS-CoV-2 tüske az exoszomális miR-148a révén az USP33-IRF9 tengelyt veszi célba a humán mikroglia aktiválása érdekében. Frontiers in Immunology 12. |
Egy másik tanulmány azt mutatja, hogy a felkarizomba befecskendezett mRNS először a nyirokcsomóba került, majd a nyirokrendszeren keresztül terjedt, és végül a lépben halmozódott fel.
| Bahl, K.; Senn, J.J.; Yuzhakov, O.; Bulychev, A.; Brito, L.A.; Hassett, K.J.; Laska M.E.; Smith, M.; Almarsson, Ö.; Thompson, J. et al. (2017). Preclinical and clinical demonstration of immunogenicity by mRNA vaccines against H10N8 and H7N9 influenza viruses. A H10N8 és H7N9 influenzavírusok elleni mRNS-vakcinák immunogenitásának preklinikai és klinikai bizonyítása. Molecular Therapy 25(6): 1316- 1327. doi: 10.1016/j.ymthe.2017.03.035 |
Ez nemcsak azt bizonyítja ismét, hogy a COVID-19 vakcinák/génterápiák összetevőjeként a felkarizomba injektált mRNS nem marad helyben, hanem azt is, hogy az mRNS tervrajzából létrehozott “pszeudo-tüskefehérje” gyulladást okozhat, vagy a gyulladásra adott immunválaszt vált ki, amennyiben az emberi szövetek fölveszik az exoszómákat, amelyek a pszeudo-tüskefehérjét hordozzák. Ez magyarázatot adhat arra, hogy a COVID-19 vakcináció/génterápia után miért alakulhat ki gyulladás a szervezet szinte bármely pontján.
Három másik tanulmány mutatja be az exoszómákon szabadon lebegő tüskés fehérjék károsító potenciálját:
| Banks, William A., Priyanka Sharma, Kristin M. Bullock, Kim M. Hansen, Nils Ludwig és Theresa L. Whiteside. Transport of extracellular vesicles across the blood-brain barrier: Brain pharmacokinetics and effects of inflammation. Az extracelluláris vezikulák szállítása a vér-agy gáton keresztül: Agyi farmakokinetika és a gyulladás hatásai. International journal of molecular sciences 21(12): 4407.
Khan, Shahanshah, Mahnoush S. Shafiei, Christopher Longoria, John W. Schoggins, Rashmin C. Savani és Hasan Zaki (2020). SARS-CoV-2 spike protein induces inflammation via TLR2-dependent activation of the NF-κB pathway. A SARS-CoV-2 tüskefehérje gyulladást indukál az NF-κB útvonal TLR2-függő aktiválásán keresztül. Elife 10. Robles, Juan Pablo, Magdalena Zamora, Elva Adan-Castro, Lourdes Siqueiros-Marquez, Gonzalo Martinez de la Escalera és Carmen Clapp (2022). The spike protein of SARS-CoV-2 induces endothelial inflammation through integrin α5β1 and NF-κB signaling. A SARS-CoV-2 tüskefehérje az integrin α5β1 és az NF-κB jelátvitel révén endotélgyulladást indukál. Journal of Biological Chemistry 298(3). |
Az első tanulmány azt mutatja, hogy az exoszómák könnyen átjutnak a vér-agy gáton, és bejutnak az agyba. Ez lehet az egyik magyarázata a trombózisok közelmúltbeli növekedésének, amelyeknek a beoltott emberek esnek áldozatul. A másik két tanulmány azt mutatja, hogy a tüskés fehérje képes gyulladást okozni, ami például vérrögökben és trombózisokban nyilvánulhat meg. Ez megmagyarázná a sok szívizom- és szívburokgyulladásos esetet, valamint a vérrögöket és trombózisokat, amelyek a beoltott embereknél a testük különböző pontjain jelentkeznek.
Végül, az a tény, hogy a tüskefehérjét hordozó exoszómák még hónapokkal a második mRNS-génterápia után is kimutathatók voltak a beoltott emberek vérében, magyarázatot adhat arra, hogy egyes beoltott emberek miért panaszkodnak még hónapokkal az oltás után is jelentős egészségkárosodásra.
Az S1 képes átjutni a vér-agy gáton. Az agy és a központi idegrendszer károsodása az eredmény:
| Rhea, Elizabeth M., Aric F. Logsdon, Kim M. Hansen, Lindsey M. Williams, May J. Reed, Kristen K. Baumann, Sarah J. Holden, Jacob Raber, William A. Banks és Michelle A. Erickson (2021). The S1 protein of SARS-CoV-2 crosses the blood–brain barrier in mice. A SARS-CoV-2 S1 fehérjéje egerekben átjut a vér-agy gáton. Nature neuroscience 24(3): 368-378. |
3, A DNS-javító funkció károsodása
Liu és munkatársai (2021) következetes változásokat találtak az immunsejtek genomjában az mRNS-vakcinák / génterápiák hatására.
“Ezek a szerzők a génexpresszióban olyan zavaró változásokat is azonosítottak, amelyek a DNS-javító képesség károsodására utalnak.”
| Liu, Jiping, Junbang Wang, Jinfang Xu, Han Xia, Yue Wang, Chunxue Zhang, Wei Chen et al. (2021). Comprehensive investigations revealed consistent pathophysiological alterations after vaccination with COVID-19 vaccines. Az átfogó vizsgálatok következetes patofiziológiai változásokat mutattak ki a COVID-19 vakcinával történő vakcinázást követően. Cell discovery 7(1): 1-15. |
Jiang és munkatársai a SARS-CoV-2 teljes tüskefehérjét a sejtmagban találják, ahonnan a tüskefehérje nyilvánvalóan sikeresen beavatkozik a DNS-javító rendszerbe, és különösen a kórokozók elleni hatékony immunvédelemhez nélkülözhetetlen b- és T-sejtek termelődését zavarja, akadályozza, gátolja.
“A DNS-károsodások javítása, különösen az NHEJ-javítás, elengedhetetlen a V(D)J-rekombinációhoz, amely a B- és T-sejtes immunitás középpontjában áll. Eddig számos engedélyezett SARS-CoV-2 vakcinát, például mRNS-vakcinákat és adenovírus-COVID-19 vakcinákat fejlesztettek ki a teljes hosszúságú tüskefehérje alapján.”
| Jiang, Hui és Ya-Fang Mei (2021). A SARS-CoV-2 tüske károsítja a DNS-károsodás javítását és gátolja a V (D) J rekombinációt In Vitro. Virusok 13(10): 2056. |
[2] inflammaszóma = gyulladástest, lásd, pl. PowerPoint bemutató (orfi.hu)
[3] “in vitro” = Az in vitro (latin, „az üvegben”) kifejezés arra a kísérleti technikára utal, amikor a kísérleti folyamat nem az élő szervezetben, hanem azon kívül, ellenőrzött körülmények közt zajlik le.
[4] proliferáció (növekedés, sarjadzás, szaporodás)
2023 február
A Sciencefiles itt megjelent írását fordította
Király József